SOLUCIÓN
Una disolución (del latín disolutio), también llamada solución, es una mezcla homogénea a nivel molecular o iónico de dos o más sustancias, que no reaccionan entre sí, cuyos componentes se encuentran en proporción que varía entre ciertos límites.1 Describe un sistema en el cual una o más sustancias están mezcladas o disueltas en forma homogénea en otra sustancia.2 . También se puede definir como una mezcla homogénea formada por un disolvente y por uno o varios solutos. Un ejemplo común podría ser un sólido disuelto en un líquido, como la sal o el azúcar disueltos en agua; o incluso el oro en mercurio, formando una amalgama.Solvente y soluto
Frecuentemente, uno de los componentes es denominado solvente, disolvente, dispersante o medio de dispersión y los demás solutos. Los criterios para decidir cuál es el disolvente y cuáles los solutos son más o menos arbitrarios; no hay una razón científica para hacer tal distinción.3Se suele llamar solvente al componente que tiene el mismo estado de agregación que la disolución; y soluto o solutos, al otro u otros componentes. Si todos tienen el mismo estado, se llama disolvente al componente que interviene en mayor proporción de masa,4 aunque muchas veces se considera disolvente al que es más frecuentemente usado como tal (por ejemplo, una disolución conteniendo 50% de etanol y 50% de agua, es denominada solución acuosa de etanol).3 En el caso de dos metales disueltos mutuamente en estado sólido, se considera disolvente a aquél cuya estructura cristalina persiste en la solución; si ambos tienen la misma estructura (ej.: aleación|aleaciones paladio-plata), se considera disolvente al metal que ocupa la mayoría de las posiciones en la estructura cristalina.5
Wilhelm Ostwald distingue tres tipos de mezclas según el tamaño de las partículas de soluto en la disolución:4
- Dispersiones, suspensiones o falsas disoluciones: cuando el diámetro de las partículas de soluto excede de 0,1 μm
- Dispersoides, coloides o disoluciones coloidales: el tamaño está entre 0,001 μm y 0,1 μm
- Dispérsidos o disoluciones verdaderas: el tamaño es menor a 0,001 μm
- Disoluciones con condensación molecular: la partícula dispersa está formada por una condensación de moléculas.
- Disoluciones moleculares: cada partícula es una molécula.
- Disoluciones iónicas: la partícula dispersa es un ion (fracción de molécula con carga eléctrica).
- Disoluciones atómicas: cada partícula dispersa es un átomo.
Molaridad

Se representa también como: M = n / V, en donde "n" es la cantidad de sustancia (n=gr soluto/PM) y "V" es el volumen de la disolución expresado en litros.
Molalidad
La molalidad (m) es el número de moles de soluto que contiene un kilogramo de disolvente. Para preparar disoluciones de una determinada molalidad, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.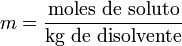
Es menos empleada que la molaridad pero igual de importante.
Normalidad
La normalidad (N) es el número de equivalentes (eq-g) de soluto (sto) por litro de disolución (Vsc).
 , o bien como el producto de la masa total y la cantidad de equivalentes por mol, dividido por la masa molar:
, o bien como el producto de la masa total y la cantidad de equivalentes por mol, dividido por la masa molar:  .
.
No hay comentarios:
Publicar un comentario