Electroquímica
Electroquímica es una rama de la química que estudia la transformación entre la energía eléctrica y la energía química.1 En otras palabras, las reacciones químicas que se dan en la interfase de un conductor eléctrico (llamado electrodo, que puede ser un metal o un semiconductor) y un conductor iónico (el electrolito) pudiendo ser una disolución y en algunos casos especiales, un sólido.2 Si una reacción química es conducida mediante una diferencia de potencial aplicada externamente, se hace referencia a una electrólisis. En cambio, si la caída de potencial eléctrico es creada como consecuencia de la reacción química , se conoce como un "acumulador de energía eléctrica", también llamado batería o celda galvánica.Las reacciones químicas donde se produce una transferencia de electrones entre moléculas se conocen como reacciones redox, y su importancia en la electroquímica es vital, pues mediante este tipo de reacciones se llevan a cabo los procesos que generan electricidad o en caso contrario, son producidos como consecuencia de ella.
En general, la electroquímica se encarga de estudiar las situaciones donde se dan reacciones de oxidación y reducción encontrándose separadas, físicamente o temporalmente, se encuentran en un entorno conectado a un circuito eléctrico. Esto último es motivo de estudio de la química analítica, en una subdisciplina conocida como análisis potenciométrico.
Celdas Electroquímicas
La linea vertical representa el limite entre dos fases. La doble linea vertical representa el puente salino. Por convención, el ánodo se escribe primero a la izquierda y los demás componentes aparecen en el mismo orden en que se encuentran al moverse de ánodo a cátodo.
Ley de Faraday
La Ley de inducción electromagnética de Faraday (o simplemente Ley de Faraday) se basa en los experimentos que Michael Faraday realizó en 1831 y establece que el voltaje inducido en un circuito cerrado es directamente proporcional a la rapidez con que cambia en el tiempo el flujo magnético que atraviesa una superficie cualquiera con el circuito como borde:1 es el campo eléctrico,
es el campo eléctrico,  es el elemento infinitesimal del contorno C,
es el elemento infinitesimal del contorno C, 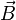 es la densidad de campo magnético y S es una superficie arbitraria, cuyo borde es C. Las direcciones del contorno C y de
es la densidad de campo magnético y S es una superficie arbitraria, cuyo borde es C. Las direcciones del contorno C y de 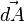 están dadas por la regla de la mano derecha.
están dadas por la regla de la mano derecha.La permutación de la integral de superficie y la derivada temporal se puede hacer siempre y cuando la superficie de integración no cambie con el tiempo.
Por medio del teorema de Stokes puede obtenerse una forma diferencial de esta ley:
En el caso de un inductor con N vueltas de alambre, la fórmula anterior se transforma en:

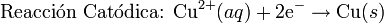


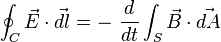


No hay comentarios:
Publicar un comentario