Estequiometría
En química, la estequiometría (del griego στοιχειον, stoicheion, 'elemento' y μετρον, métrón, 'medida') Es el cálculo de las relaciones cuantitativas entre los reactantes y productos en el transcurso de una reacción química. Estas relaciones se pueden deducir a partir de la teoría atómica, aunque históricamente se enunciaron sin hacer referencia a la composición de la materia, según distintas leyes y principios.
Ecuaciones químicas
Una ecuación química es una representación escrita de una reacción química. Se basa en el uso de símbolos químicos que identifican a los átomos
que intervienen y como se encuentran agrupados antes y después de la
reacción. Cada grupo de átomos se encuentra separado por símbolos (+) y
representa a las moléculas
que participan, cuenta además con una serie de números que indican la
cantidad de átomos de cada tipo que las forman y la cantidad de
moléculas que intervienen, y con una flecha que indica la situación
inicial y la final de la reacción. Así por ejemplo en la reacción:
Tenemos los grupos de átomos (moléculas) siguientes:
- O2
- H2
- H2O
Subíndices
Los subíndices indican la atomicidad, es decir la cantidad de átomos de cada tipo que forman cada agrupación de átomos (molécula). Así el primer grupo arriba representado, indica a una molécula que está formada por 2 átomos de oxígeno, el segundo a dos molécula formada por 2 átomos de hidrógeno, y el tercero representa a un grupo de dos átomos de hidrógeno y uno de oxígeno, es decir a la molécula agua.Coeficiente estequiométrico
Es un número que funciona en cierta forma como un multiplicador indicando el número de moléculas de un determinado tipo que participa en una ecuación química dada. En el ejemplo anterior:El coeficiente del metano es 1, el del oxígeno 2, el del dióxido de carbono 1 y el del agua 2. Los coeficientes estequiométricos son en principio números enteros, aunque para ajustar ciertas reacciones alguna vez se emplean números fraccionarios.
Cuando el coeficiente estequiométrico es igual a 1, no se escribe. Por eso, en el ejemplo CH4 y CO2 no llevan ningún coeficiente delante.
Así por ejemplo
- O2
- 2H2O
Método de balanceo por tanteo
El método de tanteo se basa simplemente en modificar los coeficientes de uno y otro lado de la ecuación hasta que se cumplan las condiciones de balance de masa. No es un método rígido, aunque tiene una serie de delineamientos principales que pueden facilitar el encontrar rápidamente la condición de igualdad.- Se comienza igualando el elemento que participa con mayor estado de oxidación en valor absoluto.
- Se continúa ordenadamente por los elementos que participan con menor estado de oxidación.
- Si la ecuación contiene oxígeno, conviene balancear el oxígeno en segunda instancia.
- Si la ecuación contiene hidrógeno, conviene balancear el hidrógeno en última instancia.
Comenzando con el carbono, se iguala de la forma más sencilla posible, es decir con coeficiente 1 a cada lado de la ecuación, y de ser necesario luego se corrige.
Balanceo de las ecuaciones Redox
Las reacciones electroquímicas se pueden balancear por el método ion-electrón donde la reacción global se divide en dos semirreacciones (una de oxidación y otra de reducción), se efectúa el balance de carga y elemento, agregando H+, OH−, H2O y/o electrones para compensar los cambios de oxidación. Antes de empezar a balancear se tiene que determinar en que medio ocurre la reacción, debido a que se procede de una manera en particular para cada medio.Medio Ácido
Se explicará por medio de un ejemplo, cuando una sal magnésica reacciona con Bismutato de Sodio.
- El primer paso es escribir la reacción sin balancear:
- Luego se divide en dos semirreacciones:
- Cada semirreación se balancea de acuerdo con el número y tipo de átomos y cargas. Como estamos en medio ácido los iones H+ se agregan para balancear los átomos de H y se agrega H2O para balancear los átomos de O.
- Finalmente se multiplica cada semirreacción por un factor para que se cancelen los electrones cuando se sumen ambas semireacciones.
- Reacción Balanceada:
- En algunos casos es necesario agregar contraiones para terminar de balancear la ecuación. Para este caso, si se conociera el anión de la sal magnésica, ese seria el contraión. Se agrega por igual de ambos lados de la ecuación lo necesario para terminar de balancearla.
Medio Alcalino
También se explicará por medio de un ejemplo, cuando el Permanganato de potasio reacciona con el Sulfito de sodio.
- El primer paso es escribir la reacción sin balancear:
- Luego se divide en dos semirreacciones:
- Cada semirreación se balancea de acuerdo con el número y tipo de átomos y cargas. Como estamos en medio alcalino los OH− se agregan para balancear los átomos de H y normalmente se agrega la mitad de moléculas de H2O del otro lado de la semirreacción para balancear los átomos de O.
- Finalmente se multiplica cada semirreación por un factor para que se cancelen los electrones cuando se sumen ambas semireacciones.
- Reacción Balanceada:
- En este caso se agregaron contraiones para terminar de balancear la ecuación (los cationes K+ y Na+)
Leyes estequiométricas
Ley de la conservación de la materia de Lavoisier
En toda reacción química se conserva la masa;
esto es: la masa total de los reactivos es igual a la masa total de los
productos resultantes. La ley de conservación de la masa, enunciada por
Lavoisier, es una de las leyes fundamentales en todas las ciencias naturales. En esta ley se asume la conservación de la cantidad de átomos. Para ello resulta indispensable el balanceo de ecuaciones químicas. Se puede enunciar de la manera siguiente: en cualquier reacción química se conserva la masa. Es decir: la materia no se crea, ni se destruye, sólo se transforma, y permanece invariable.
Ley de Proust o de las proporciones constantes
En 1808, J. L. Proust llegó a la conclusión de que, para generar un compuesto determinado, dos o más elementos químicos se unen entre sí, siempre en la misma proporción ponderal (del latín pondus, pondéris: casos nominativo y genitivo de peso).
Una aplicación de la ley de Proust es en la obtención de la denominada composición centesimal de un compuesto, es decir el porcentaje ponderal que dentro de la molécula representa cada elemento.Ley de Dalton o de las proporciones múltiples
Puede ocurrir que dos elementos se combinan y -en vez de producir un solo compuesto- generen varios compuestos (caso previsto en la ley de Proust).
En 1808, Dalton concluyó que el peso de uno de los elementos combinados con un mismo peso del otro guarda una relación expresable por lo general mediante un cociente de números enteros pequeños.Ley de las proporciones equivalentes o recíprocas (Richter 1792)
"Si dos elementos se combinan con cierta masa fija de un tercero en cantidades a y b, respectivamente, en caso de que aquellos elementos se combinen entre sí lo hacen según una relación sencilla de masas a/b.
Es decir: siempre que dos elementos reaccionan entre sí, lo hacen en
equivalencia o según múltiplos o submúltiplos de los elementos."





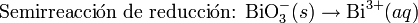
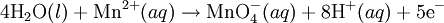


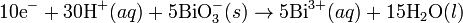
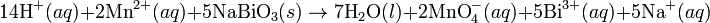



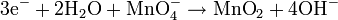

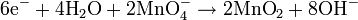


No hay comentarios:
Publicar un comentario