Cinética Química
La cinética química es un área de la fisicoquímica que se encarga del estudio de la rapidez de reacción, cómo cambia la rapidez de reacción bajo condiciones variables y qué eventos moleculares se efectúan mediante la reacción general (Difusión, ciencia de superficies, catálisis). La cinética química es un estudio puramente empírico y experimental; el área química que permite indagar en las mecánicas de reacción se conoce como dinámica química.Cinética de las Reacciones
El objeto de la cinética química es medir las velocidades de las reacciones químicas y encontrar ecuaciones que relacionen la velocidad de una reacción con variables experimentales.Se encuentra experimentalmente que la velocidad de una reacción depende mayormente de la temperatura y las concentraciones de las especies involucradas en la reacción. En las reacciones simples, sólo la concentración de los reactivos afecta la velocidad de reacción junto con la temperatura, pero en reacciones más complejas la velocidad también puede depender de la concentración de uno o más productos. La presencia de un catalizador también afecta la velocidad de reacción; en este caso puede aumentar su velocidad. Del estudio de la velocidad de una reacción y su dependencia con todos estos factores se puede saber mucho acerca de los pasos en detalle para ir de reactivos a productos. Esto ultimo es el mecanismo de reacción.
Las reacciones se pueden clasificar cinéticamente en homogéneas y heterogéneas. La primera ocurre en una fase y la segunda en más de una fase. La reacción heterogénea depende del área de una superficie ya sea la de las paredes del vaso o de un catalizador sólido. En este capítulo se discuten reacciones homogéneas.
Rapidez de reacción
Para una reacción de la forma: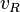 es la rapidez de la reacción,
es la rapidez de la reacción,  la disminución de la concentración del reactivo A en el tiempo
la disminución de la concentración del reactivo A en el tiempo 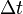 . Esta rapidez es la rapidez media de la reacción, pues todas las moléculas necesitan tiempos distintos para reaccionar.
. Esta rapidez es la rapidez media de la reacción, pues todas las moléculas necesitan tiempos distintos para reaccionar.La rapidez de aparición del producto es igual a la rapidez de desaparición del reactivo. De este modo, la ley de la rapidez se puede escribir de la siguiente forma:
- La actividad química, es decir, la "concentración efectiva"
- La cantidad de los reactivos en proporción a la cantidad de los productos y del disolvente
- La temperatura
- La energía de colisión
- Presencia de catalizadores
- La presión parcial de gases
Ley de Acción Masas
En una reacción química elemental y homogénea,2 cuando el cambio de energía libre de Gibbs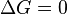 debe cumplirse que
debe cumplirse que![\frac{ [X_{k+1}]^{v_{k+1}} ... [X_{m}]^{v_{m}} }{[X_{l}]^{v_{l}} ... [X_{k}]^{v_{k}} }= K_{eq}](http://upload.wikimedia.org/math/8/c/7/8c7d582905c4f3ef2ad05cf7efb387d9.png)
en equilibrio donde la constante de equilibrio Keq




No hay comentarios:
Publicar un comentario